
老化治療の最先端「セノリティクス」で健康寿命はどこまで延びるか

今、世界が注目する「セノリティクス」とは、老化細胞除去という意味です。薬品などによって老化細胞を除去し、老化を防止・遅延させれば老化によって起きるさまざまな病気の予防や改善につながるのではないか。こうした考えの下、東京大学医科学研究所所長で癌防御シグナル分野の中西真(なかにし・まこと)教授は研究を進め、老化細胞を選択的に除去する「GLS1阻害薬」が加齢現象や病気を改善することを証明。新たなアンチエイジング療法の開発に貢献することが期待されています。
人はなぜ、どのように老いるのか?
中西先生は大学院生の頃から老化に関心をお持ちだったそうですが、老化を専門領域に選ばれた理由は何ですか?
老化に興味をもった理由は2つあります。1つは老化のメカニズムを解き明かしたいと考えたことです。老化は摩訶不思議な現象のように思えますが、血液循環や呼吸などと同じように、誰もが長期間にわたって経験する普遍的な生理現象です。それがどんなメカニズムによって起こり、どんな分子が関わっているのか。それを知りたいと考えました。
もう1つの理由は、老化は非常に多くの病気の危険因子であるからです。大学卒業後に1年ほど老人病院で臨床に携わっていたのですが、ほとんどの高齢者が複数の病気を抱えていて「老化があらゆる臓器組織の病気の源なのだ」という印象を持ちました。老化を克服できれば、加齢に伴って起きるさまざまな疾患から解放され、社会に大きな貢献ができるのではと思ったのです。

中西先生の学生時代、1980年代は今ほど老化研究が盛んではなかったと思います。
そんな中、どのように研究に着手されたのでしょうか。
最初は「老化とは何か」もわからなかったので、手探りで研究を始めました。老化には栄養やエネルギー産生の低下が関わっていると考えたので、大学院生のとき、ミトコンドリアのエネルギー産生を専門領域とされている自治医科大学の香川靖雄教授のもとに内地留学させていただきました。ミトコンドリアの機能不全に関わる病気の一つに「ミトコンドリア脳筋症」があります。しかし、この病気の患者は典型的な早老症というわけではありません。ミトコンドリアと老化には関係があるのかどうか。それを模索している時期に「細胞老化」という現象を知りました。
「細胞老化」と「個体の老化」は相関している
細胞老化とはどのような現象ですか?
細胞老化とは、分裂細胞がそれ以上分裂しなくなり、「細胞周期」が停止した状態のことです。細胞は増殖をやめても死滅せず、生き続けます。当時、細胞老化は(ヒト個体の)老化研究の主流ではありませんでしたが、「細胞分裂の回数と、個体の老化との関連が強く疑われる」という論文が出始めていて、これは面白いと思い、細胞老化研究の本場であるアメリカに留学したのです。
留学先のラボは「細胞周期」の制御に直接関わる分子を発見したばかりで、世界中の注目を集めていました。しかもその分子は、細胞老化に関わっているのです。当時、老化というテーマは医学界のトレンドからは少し離れたところにありましたが、この発見によって「細胞老化は細胞周期制御と密接に関わっている」ということが明らかとなり、いきなり医学研究のトレンドのど真ん中に入ったわけです。そうなると研究はものすごく加速しますし、競争も激化します。自然、私の研究スタイルや研究に対する考え方も変わってきました。
細胞老化と個体の老化の関係について、もう少し詳しく教えてください。
種の寿命と細胞分裂の回数の間には、非常によい相関があります。例えばマウスは短命で、細胞分裂の回数が非常に少ない。それに対してヒトの寿命は80〜90歳と長く、細胞分裂の回数は50〜60回ほどと多い。他の生物でも同じことがいえます。細胞老化とは「これ以上細胞分裂ができない」状態ですから、これが個体の老化や寿命に関わっているのではないかと注目されたのです。その後の遺伝子改変マウスを用いた実験で、個体から老化細胞を人工的に除去すると、その個体の老化状態が改善されたという結果が出ました。これがさらに、細胞老化をベースにした老化研究を推し進めたのです。
GLS1が老化細胞を除去するメカニズム
中西先生の研究チームは2021年1月15日、科学雑誌『Science』に「老化細胞を選択的に除去するGLS1阻害薬が加齢現象を改善し、老年病・生活習慣病の一種である肥満性糖尿病、動脈硬化、非アルコール性脂肪肝(NASH)の症状改善に有効であることを証明した」と発表しました。この発表に至る経緯をお話しください。

私たちは、細胞老化がどのように誘導されるかというテーマに長年取り組んできました。老化細胞は、普通の細胞とはかなり違った形質を持っています。なぜそのような形質が誘導されるかを研究する中で、細胞老化に関連する分子や細胞周期についても深く理解し、発表することができました。

このご研究が、GLS1阻害薬の利用という発想につながったのですか?
そうですね。老化細胞の性質を調べて、そのアキレス腱(急所)、つまり細胞老化の生存に重要な分子がわかれば、それを叩く薬が見つかるだろうと考えていました。しかも、その薬は安全性が高いものでなければいけません。実は老化細胞を強制的にアポトーシス(細胞の自然死)に誘導する薬は以前からあります。しかし、そうした薬は諸刃の剣的なところがあって、副作用が強い。老化は誰もが経験するもので、危険を冒して治療する必要はありませんから、強力な薬を使ってよいかどうかは疑問です。できればよりマイルドに作用して老化細胞を除去し、しかも安全性が高いものはないかと探していたところ、GLS1阻害薬に行きつきました。
GLS1(グルタミナーゼ1)はグルタミン酸代謝に関わる酵素ですが、加齢に伴って増え、細胞分裂が止まった後も老化細胞を生かし続ける作用をもっています。GLS1は細胞の機能にとって常に不可欠というほどではないので、その働きを阻害しても人体への影響は少なくて済みます。こうした点から、GLS1阻害薬が老化細胞の除去に適していると考えました。
GLS1阻害薬が老化細胞を除去するメカニズムを教えてください。
細胞の中には、細胞内のタンパク質の分解に重要な役割を果たす「リソソーム」という小器官があります。リソソームの膜に傷がつくと、リソソームに含まれる酸性物質が細胞内に流れ出し、細胞を酸性化させます。酸性化した細胞は本来死滅しますが、老化細胞の場合は細胞内のpHが低下するとGLS1を増やしてアンモニアを産生させて細胞内のpHを中和させ、生き延びているのです。そこで、老化細胞においてGLS1の働きを阻害してみたところ、細胞内のpHが大きく低下し、細胞死が誘導されました。
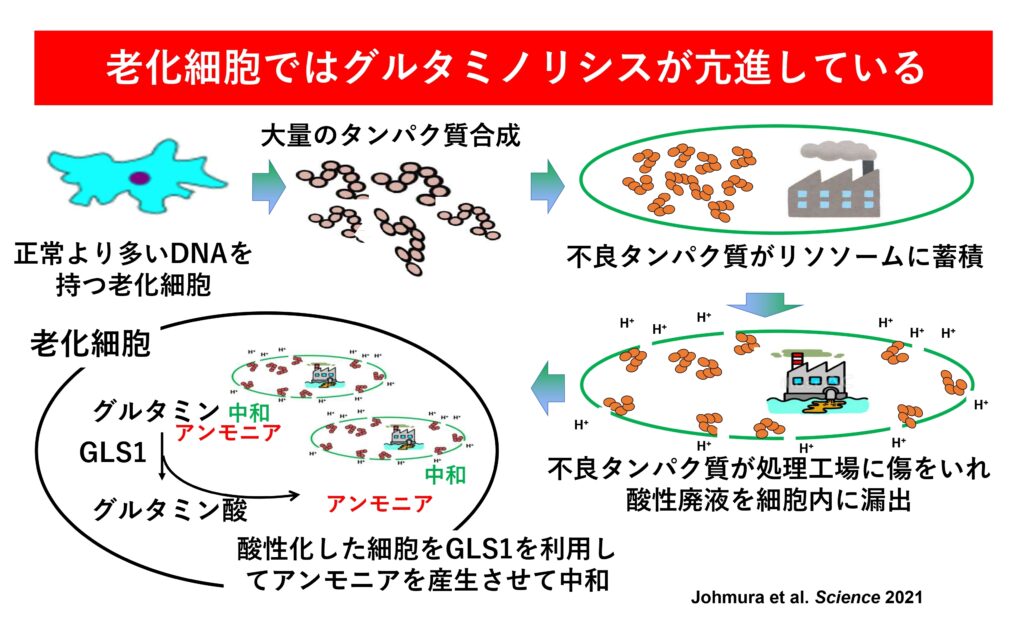
GLS1阻害薬が生活習慣病や老年病を改善し、がんを防ぐ
老齢マウスによる実験で、GLS1阻害薬がさまざまな病気の症状を改善することを確認されました。
老齢マウスにGLS1阻害薬を投与したところ、さまざまな臓器・組織で老化細胞の除去が確認できました。また、さまざまな加齢関連疾患モデルマウスによる試験の結果、肥満性糖尿病、動脈硬化、非アルコール性脂肪肝(NASH)の症状改善に有効であることがわかりました。
老化細胞が除去されたことで炎症が抑えられ、炎症に起因する病気の症状が改善したのですね。
その通りです。歳をとると、炎症を誘発する細胞が体内にたまってきます。そのような細胞の代表が老化細胞です。老化細胞がたまるとさまざまな臓器や組織に慢性的な炎症が起こってその機能を衰えさせ、生活習慣病や動脈硬化などの原因となります。したがって、老化細胞を除去して慢性炎症が起きなくなれば、さまざまな病気の予防・改善ができると考えられます。
中西先生はがんの研究にも注力なさっていますが、この研究の成果はがん対策にも応用できますか。
大多数のがんは、老化が大きな原因の1つと考えられていますから、老化のメカニズムがわかり、有効な対策を打てればがんはある程度予防できると考えています。
食品によるセノリティクスは可能か
先生は内閣府のムーンショット型研究開発事業のプロジェクトマネジャーをとして、
「老化細胞を除去して健康寿命を延伸する」をテーマに研究開発に取り組んでいらっしゃいます。
このプロジェクトに関して、今後の展望をお話しいただけますか。
老化細胞以外にも、体内に炎症を起こす細胞はいくつかあります。そのすべてを一網打尽に除去する技術を社会実装することを目標としています。炎症の抑制によって、100歳頃まで健康に生きられる社会を実現したいのです。我々を含めた多くの研究によって、「老化は制御できる」ことはすでに明らかです。しかし、それがいつ実現できるかまでは予測できません。個人的には10年以内にブレークスルーが起き、老化制御にかなり近づけるだろうという感触は持っています。
老化を制御するために、薬以外の手段はあるのでしょうか。
例えば、食品によるセノリティクス(老化防止)が実現する可能性はありますか?
あり得ると思います。例えば、50年前の50歳と今の50歳を比べると、今の50歳のほうが明らかに若々しいですよね。その要因の一つは栄養だと思います。近年、栄養についての知識が普及し、十分な栄養摂取が可能となりました。これによって老化が遅くなっていると考えるのが自然です。そもそも食品と薬はそれほどかけ離れたものではなく、どちらも体に有益にもなり、毒にもなりえます。薬と同様に、食品もセノリティクスに役立つ可能性は十分にあります。

セノリティクスの観点から、今後の食品の研究開発に期待されることは何ですか?
医薬品と同様に、食品の開発研究においても、数値やエビデンスをはっきり打ち出せる研究を行えば、もっと急激な進歩が起きると思います。「これはたぶんいいだろう」と経験からわかっている食品に対しても、あらためて研究して数値を出し、統計学的な有意差を示せれば、積極的に利用する人も増えてくるでしょう。
老化に関する研究は、長期間の観察が必要な点が難しいと聞いています。
医薬品でも食品でも、研究の拠り所となるのは統計学的な有意差です。これを出すためには長期にわたる解析をする以外に、解析対象の数を増やすという方法があります。老化に関していえば、 仮にその変化が小さなものや短期間の変化であっても、大規模な調査を行えば、統計学的有意差が得られます。医薬品の試験は、対象となる疾患がなければ実施できませんが、食品の場合はそのような制限がないので、医薬品よりも大規模な研究がしやすいはずです。

中西 真 教授 プロフィール
東京大学 医科学研究所 癌防御シグナル分野 教授。
1985年名古屋市立大学医学部卒業、1989年同大大学院医学研究科博士課程修了(医学博士)。自治医科大学医学部生化学講座講師、国立長寿医療研究センター老年病研究部長室、名古屋市立大学大学院医学研究科基礎医科学講座細胞生化学分野教授などを経て、2016年より現職。2023年より東京大学医科学研究所所長。内閣府のムーンショット型研究開発事業「老化細胞を除去して健康寿命を延伸する」プロジェクトマネジャーを務める。著書は『老化は治療できる!』(宝島社新書)。


































